|
|
Acer 30-32. 08038 BARCELONA |
|
 |
|
|
|
Reactivos de Detección de Aminoácidos PIERCE |
 |
 |
 |
| NINHIDRINA | 2,2-Dihidroxiindano-1,3-diona | Para Detección Espectrométrica de Aminoácidos |
|
La Ninhidrina de Thermo Scientific
Pierce se ha usado en todos los avances en análisis de aminoácidos desde
que en 1949 Stein y Moore1, desarrollaron las bases de los
métodos cromatográficos. Así los procedimientos más actuales y los
instrumentos más sensibles necesitan la excelente respuesta de color y
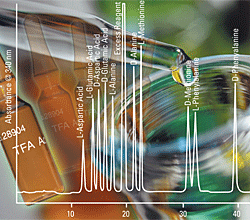
blancos limpios que sólo la ninhidrina puede ofrecer. La Ninhidrina de Thermo Scientific Pierce es estable indefinidamente y no necesita refrigeración o cuidados especiales para su almacenamiento: es suficiente mantener la botella bien cerrada, evitar el sol directo y el amoníaco en la atmósfera del laboratorio. La reacción entre los compuestos que contengan aminoácidos y la ninhidrina es muy sensible. McCaldin ha estudiado todas las fases de la química de la Nihidrina y ha propuesto un mecanismo para la reacción con los aminoácidos, teniendo en cuenta los aldehídos, dióxido de carbono, amoniaco e hidridantina4. Con los aminoácidos secundarios prolina e hidroxiprolina, se forma un compuesto amarillo (detectable a 440 nm)5. La Ninhidrina decarboxila y deamina los aminoácidos primarios formando el compuesto púrpura conocido como Púrpura de Ruhemann6, que absorbe a 570 nm. 
En 1958 Spackman, Stein y Moore7, adaptaron esta reacción a un sistema totalmente automático de análisis de aminoácidos con dos columnas. Moore y Stein definieron las necesidades de un agente reductor (como el cloruro de estaño) para obtener valores de color reproducibles para el análisis de aminoácidos con nihnidrina8. James sugirió el uso de cloruro de titanio para eliminar los precipitados causados por el usos del cloruro de estaño9-11. Los solventes más usuales son el metilcellosolve (etilénglicol monometil éter) tamponado a pH 5.5 con Acetato Sódico 4M12, y el DMSO tamponado a pH 5.213 con acetato de Litio, éste último permitiendo una mayor estabilidad que el metilcellosolve (Kirschenbaum 14). El rol de la hidridantina en el análisi de aminoácidos fue descrito por Lamonthe y McCormick15. La sensibilidad de un sistema con ninhidrina depende de varios factores. Los aminoácidos producen rendimientos de color ligeramente diferentes y estos valores pueden variar de una preparación de reactivos a otra. La ninhidrina también es sensible a la luz, al oxígeno atmosférico y a cambios de pH y temperatura. Cundo la ninhidrina empieza a oxidarse, su color no se desarrolla bien a 570nm, mientras que la adsorción a 440nm se mantiene bastante constante. Una altura del pico de la Prolina a 440 nm cercana a la altura del pico del ácido glutámico a 570nm, para cantidades iguales de ambos, indica una degradación del reactivo. |
| Información de Producto |
| Código | Descripción | Tamaño, Pk. |
| TS-21003 | Ninhidrina (2,2-Dihidroxiindano-1,3-diona) | 500 g. |
| Catálogos | ||
|
|
Pierce Handbook | 7.7 Mb |
| Referencias |
|
|
Otros Productos recomendados |
.gif) |
 |
 |
 |
| Reacti-Vap Evaporadores/Agitadores | Reacti-Viales | Hipo-Viales | Viales Prelimpiados |
Copyright© 2006-2014 CromLab S.L. Prohibida la reproducción total o parcial sin consentimiento escrito del propietario.